
在免疫学的传统认知里,我们的免疫系统是一支攻击力强大的军队,负责识别并清除外来病原体。然而,一个更深层的问题困扰了科学家数十年:这支强大的军队为何不会“倒戈一击”,对自身组织发动战争?

2025年诺贝尔生理学或医学奖,授予了玛丽・布伦科(Mary E. Brunkow)、弗雷德・拉姆斯德尔(Fred Ramsdell)和坂口志文(Shimon Sakaguchi),以表彰他们 “关于外周免疫耐受的发现”。
2025年诺贝尔生理学或医学奖为我们揭晓了答案。三位科学家的研究共同解答了一个免疫学的核心问题:免疫系统如何区分“自我”与“非我”,从而在攻击病原体的同时不伤害自身组织?
坂口志文的开创性发现:在20世纪90年代,主流观点认为免疫耐受主要通过胸腺的“中枢耐受”机制实现。但坂口志文通过实验证明,存在一种特殊的T细胞—调节性T细胞,它们像“安全卫士”一样,能在身体外周环境中主动抑制其他免疫细胞的攻击,维持对自身组织的耐受。
布伦科与拉姆斯德尔的基因突破:几乎在同一时间,布伦科和拉姆斯德尔在研究患有严重自身免疫病(scurfy)的小鼠时,发现了关键的 Foxp3基因。他们证实,该基因的突变会导致人类和小鼠出现致命的自身免疫疾病。
理论的统一:2003年,坂口志文进一步将这两个发现联系起来,证明Foxp3基因是调节性T细胞的主控基因,控制着它们的发育和功能。这三位科学家的研究共同确立了外周免疫耐受的细胞与分子基础。
超越耐受:Treg细胞作为“活体药物”的技术前沿
治疗自身免疫病与移植排斥:对于类风湿性关节炎、Ⅰ型糖尿病等自身免疫病患者,其体内的“免疫刹车”Treg细胞数量不足或功能缺陷,相应的细胞治疗策略是“扩军和赋能”。
精准靶向与解除刹车:在肿瘤微环境中,Treg细胞常常“助纣为虐”,过度抑制了能够杀伤肿瘤的效应T细胞。因此,在肿瘤治疗领域,策略是“精准打击”或“暂时解除刹车“。
工程化Treg细胞治疗
CAR-Treg(嵌合抗原受体Treg):通过基因工程,为Treg细胞装上“导航头”,使其能精准富集到特定组织。例如,设计靶向肝脏抗原的CAR-Treg,可用于治疗肝移植后的排斥反应;靶向髓鞘蛋白的CAR-Treg,则有望治疗多发性硬化症。这实现了“指哪打哪”的局部免疫抑制,极大提高了安全性和有效性。
可控性安全开关:为确保绝对安全,可以在Treg细胞中引入了“自杀开关”。一旦治疗出现不可控的副作用,可以通过给予特定小分子药物,迅速清除体内的工程化Treg细胞,从而按下“紧急制动按钮”。
随着Treg细胞研究迈向纵深,领域内对研究工具的特异性与可重复性提出了**未有的高标准。Abcam致力于提供覆盖全研究路径的高品质抗体,加速在这一诺奖级领域的创新发现。
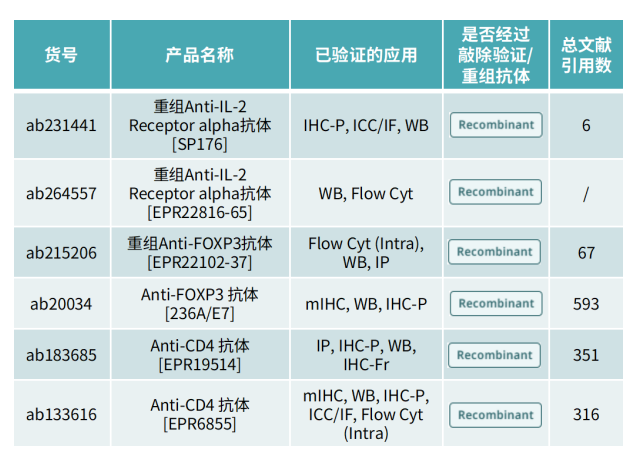
产品推荐
【END】
部分图片、字体、文字来源于网络 如有侵权请联系删除
©2022-2025 柏澳集 All Rights Reserved. 苏ICP备19039921号-2
建议您使用Chrome、Firefox、Edge、IE10及以上版本和360等主流浏览器浏览本网站。
本网站销售的所有产品均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。
互联网药品信息服务资格证书编号:苏-经营性-2022-0029 、增值电信业务经营许可证:苏B2-20221250 、医疗器械生产(经营)许可证或备案凭证编号:苏泰食药监械经营备20207022号